合成生物学是一门神奇的学科,它可以让我们用工程的思维,设计和制造出全新的生物体。如今,科学家已经成功地合成了酵母的全部16条染色体,并将其中一半放入了一个细胞中,创造出了一个半人工的酵母。他们还为这个酵母设计了一条新的染色体,让它基因组更加稳定的同时也能保证功能的完整。
这些成果是合成生物学的里程碑,也是人类向完全人工合成的真核细胞迈进的一大步。
撰文 | 顾舒晨
2023年11月8日,著名科学期刊Cell、Molecular Cell及Cell Genomics聚焦于同一主题,一口气刊载10篇研究论文,介绍国际合作项目“人工合成酵母基因组计划”(Sc2.0)。这批成果由来自美国、中国、英国等国家的科研团队共同完成,文章详细报道了8条全新的酵母染色体的全面合成和一条转运RNA(tRNA)染色体的创新设计与合成。
至此,Sc2.0已完成全部16条酵母染色体的人工合成,其中包括早先合成的6条以及尚未发表但已完成的2条染色体。科学家还将7.5条染色体成功地整合到了天然酿酒酵母的菌株中,这种半人工酵母拥有与野生的酵母菌株相似的生存和复制能力[1]。也就是说,一半天然、一半人工合成的酵母细胞问世!科学家还为酵母细胞编写设计了一条全新的染色体—— tRNA染色体[2],这为创造出世界上第一个完全人工合成的真核细胞迈出了新的一步。
这些激动人心的成果,都属于一个崭新的学科——合成生物学。如今,前述这一系列突破,意味着人类已经从对少数基因的修补,发展到了能够从头设计和构建整个基因组。
合成生物学是什么?
合成生物学是近年来异军突起的新兴前沿交叉学科,被认为是继“DNA双螺旋发现”和“人类基因组测序计划”之后的第三次生物技术革命。2004年《麻省理工科技评论》把合成生物学评为将改变世界的十大技术之一,2010年Science也将其列为十大科学突破第二名。
它以基因工程、系统生物学、计算机工程等多学科为基础,采用工程化的设计理念,对生物体遗传物质进行设计、改造乃至全新合成,从而打破物种界限,创造人工生命体。合成生物学不仅有潜力帮助我们解决人类社会面临的诸多挑战,而且能让我们从“造物”这一全新的视角,来揭开基础生命科学的奥秘。
合成生物学的本质在于设计和创造,无论是“改造已有的天然生物系统”还是“设计和建造新的生物元件、装置和系统”,都是基于DNA进行的。合成生物学的一般过程是“设计-构建-测试-学习-再构建”的研究循环。
科学家会先使用计算机软件辅助设计要合成的DNA构建。设计的DNA将被分为1–1.5kb的可合成片段(synthons)。合成片段可以通过单链寡核苷酸进行组装拼接合成,组装成更大的DNA元件。组装好的DNA需要进行两步验证:序列验证和将其转化到细胞后的功能验证。根据验证结果,进行修改,重复测试循环,直到获得所需要功能的DNA构建体[3]。
然而,生命元件的组装不像电路组装那样简单。虽然我们知道,生命体中的所有生命元件都是由DNA翻译而来,但我们对很多元件缺乏深刻的了解。这些元件的功能也可能会因为时间、位置、条件等的不同而改变。因此,即使我们知道每一种元件的功能,当我们将这些不同的生物元件组装起来以后,它们的功能也可能会缺失或者“互不兼容”。
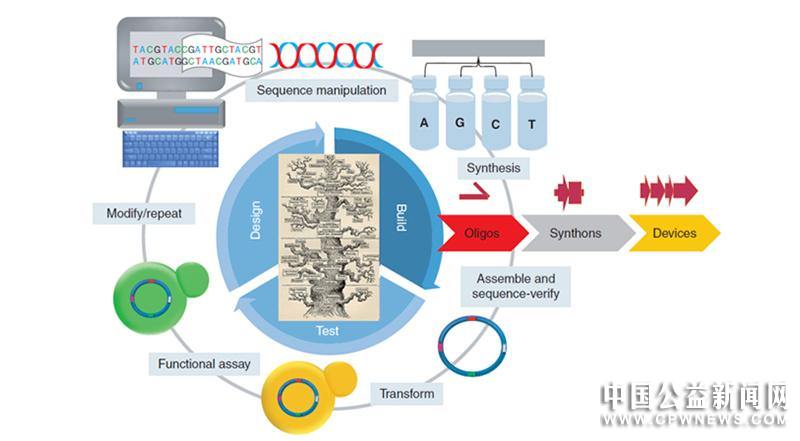
图1合成生物学测试周期[3]。
2010-2020年,随着生物技术和生物工程的发展,合成生物学飞速前进。2010年,美国克雷格·文特尔研究所(J.Craig Venter Institute,缩写JCVI)的研究人员宣布构建出了第一个人造细胞——“合成支原体”JCVI-syn1.0[4]。2021年该项目的研究人员更是宣布,在JCVI-syn1.0的基础上人工合成了仅有473个基因的“最简化细胞”JCVI-syn3.0[5]。虽然支原体是原核细胞,相对于真核细胞结构简单很多,但支原体的人工合成依然激发了科学家的雄心, Sc2.0计划也由此开启。
首次尝试合成真核生物基因组
酵母是与人类生活关系非常密切的一类单细胞真核微生物,因为其清晰的遗传背景,酵母也成为科学研究最常用的模式生物之一。早在1996年,科学家就完成了酿酒酵母(Saccharomyces cerevisiae)全基因组测序,并发现该基因组总共约6000个基因,其中有5000个不是维持酵母生命活动所必需的,可以进行删减和改写。
2007年,纽约大学的杰夫·博伊克(Jef D.Boeke)教授发起了一个全球化的真核生物研究合作项目——Sc2.0计划。该项目分布在全球许多国家,其中美国和中国分别占总合成的28%和39%。2011年,Sc2.0计划在美国、中国、英国、新加坡、澳大利亚等国正式启动,该计划旨在完成设计和化学再造完整的酿酒酵母的全部16条染色体,从而为系统性研究真核生物染色体提供应用平台。这是人类首次尝试对真核生物的基因组进行从头设计合成[6]。
为完成目标,研究人员将从头开始合成酵母基因组,去除所有转座子和重复元件,重新编码终止密码子,并将转运RNA基因搬到全新的染色体上,同时还要避免引起适应性缺陷,并增加有助于染色体构建和操作的特征。在Sc2.0计划的设计过程中,虽然对基因序列进行了碱基删除、插入和替换,但原则上仍要保持合成菌株与天然菌株的相同表型,同时也要保证基因组的稳定性。为了增强遗传灵活性,科学家也对野生型的基因组序列进行了优化[6]。
2014年,博伊克教授领衔的研究团队创建出了第一条人工酵母染色体(酵母染色体中最小的3号染色体)[7]。2017年,Sc2.0计划国际协作组宣布完成了三分之一酵母基因组的设计与全合成,Science杂志以特刊形式进行了报道[8]。这标志着Sc2.0计划向前推进了一大步。
现在,科学家已经完成了16条染色体的合成,并分别创造出了16种部分合成的酵母菌株,即每种细胞内包含15条天然染色体和1条合成染色体[1]。科学家还将含有不同合成染色体的酵母细胞进行杂交,并在其后代中寻找携带两条合成染色体的个体,逐渐将人工合成的染色体组合起来,形成一个完全合成的新细胞。经过漫长的杂交过程,现在已有6条完整染色体和1条染色体臂整合到了同一个细胞中,由此产生的拥有6.5条人工染色体的酵母菌株中合成的DNA占比超过31%,并且形态正常,与野生酵母相比,只表现出轻微的生长缺陷[1]。

图2 扫描电镜下,拥有6.5条合成染色体的酵母细胞,表现出正常的外形和出芽行为[1]
为了增加染色体的置换效率,科学家还开发了一种高效的染色体置换的新方法。他们用这个方法转移了酵母染色体中最大的染色体(4号染色体,synIV),从而得到了一个拥有7.5条染色体的酵母细胞,其合成的DNA占比超过50%。虽然该酵母的染色体发生了巨大变化,但它仍可以存活并且可以复制[1]。
Sc2.0的主要目标之一是提高酵母基因组的稳定性。但天然的酵母细胞中有着大量的重复DNA,它们不编码任何东西,却能通过自然过程相互重组,导致基因组发生重大结构变化并变得不稳定。为了更好地控制酵母细胞,Sc2.0团队用计算机程序梳理了酵母的基因组,找到高度重复的DNA区域并删除了它们,这其中就包括编码tRNA的所有DNA片段。虽然这些DNA序列是不稳定的,但它们所编码的tRNAs对细胞的功能至关重要。因此科学家将编码tRNA的全部基因集中到了一条新染色体——tRNA新染色体上,再将其添加到完全人工合成的酵母细胞里面[2]。这也为研究人员更好控制合成酵母菌,以及探索生物学极限提供了一种新方法。
当然,这样一个大体量的科研工程也并不是一帆风顺的。在项目初期,科研团队就经历过项目技术研发的挫折,不仅碰到了复杂的序列,造成了合成的难度,也有因为基因本身的编码问题而导致常规合成克隆无法完成。另外,当基因组越来越大时,如何进一步提升效率,降低成本,也是科学家们需要解决的问题。项目执行过程中最耗时耗力的部分还包括合成缺陷的定位与修复,这也是合成酵母基因组的最大难点之一。相比其它合成基因组,合成酵母中涉及的序列数量多且复杂,其缺陷排查工作就像大海捞针一样,需要进行大量的验证工作。但最终,多国科学家通过共同努力迎来了Sc2.0计划的顺利进展,而把所有人工染色体放入同一个酵母中将会是未来的一个新挑战。
基于前期Sc2.0研究的顺利进行,科学家也意识到我们可以对酵母基因组进行更深层次的改造,用以研究特定的生物学问题或者实现相关应用目标。因此,中国科学家戴俊彪研究员与英国曼切斯特大学的蔡毅之教授、美国纽约大学的博伊克教授共同牵头发起了Sc3.0计划。在该计划中,科学家们将对酵母基因组进行更精简和深度的设计,构建首个最小酵母基因组,用以探索重大的生物学问题,例如:有哪些酵母基因是可删减却不影响活性的?它们在进化上的意义是什么?在给定条件下,维持真核生命的最小基因组需要哪些功能、野生型基因组的组织形式是否具有重大的生物学意义、我们能否在基因组范围内对基因的排布和调控进行人为的设计,等等。Sc3.0计划的倡议和项目介绍也已于2020年刊发在Genome Biology杂志[9]。
现在人类已经能够创造生命了么?
不,目前我们仅仅只是照着课本抄了一遍答案。本质上这种合成的酵母细胞并没有脱离自然界的基因模板,只是对已有的基因进行了复制或修改,这不能说是“从头创新”,而只是基于图谱的“再优化”。每一点“优化”都需要再深度验证是否会影响到酵母自身的生存活性。我们对生命的理解也远没有达到可以从头创新的阶段。目前,科学家虽然已经能够人工合成真核生物的基因组,但还不能将全部的人工基因组放入同一个真核细胞中。想要直接“从无到有”地构建一个细胞,或者进一步说不依赖于自然界的基因序列设计出一系列全新的基因组,科学家还需要对细胞的结构、基因的功能和调控有更深入的理解,对生命的本质和起源有更清晰的认识。
但我们依然在慢慢“颠覆”达尔文的进化论,相较于Sc1.0(天然酵母),Sc2.0计划可以作为工具,通过外源导入基因后,直接“造物”。从理论上说,人工设计与合成酵母基因组及其后续的基因组快速进化研究,不仅可实现对酵母全基因组功能研究,还能通过基因组随机变化产生的酵母菌库为研究酵母演化史提供大量的素材。另外,酵母与人类的生活息息相关,它是酿酒和制作面包所必需的重要材料。在工业上,酵母能为我们生产很多物质,比如通过在酵母中加入合成青蒿素的相关基因可以实现青蒿素的大量生产。未来我们还可以将一些其它微生物合成的物质放到人造酵母里面进行生产,如抗生素、味精甚至玻尿酸等等。可以说,人造酵母拥有很多改善人们生活的应用潜力,在食物生产、药物生产、生物能源、生物材料等领域都可以得到广泛应用。
2010年,“人类基因组之父”克雷格·文特尔(Craig Venter)将一种名为丝状支原体的微生物DNA进行重组,并将新的DNA片段“粘”在一起,植入另一种细菌中制造了第一个所谓的“人造生命”[10]。虽然这一成果在当时造成了不小的争议,但他在这个“人造生命”的基因组中加入的一小段人类的文本却让人印象深刻,“To live, to err, to fall, to triumph, to recreate life out of life”(去生活、去犯错、去失败、去胜利,去用生命重新创造生命)。大自然创造了人类世界,或许人类也可以向着更美好的家园再创世纪。
参考文献
[1] doi: 10.1016/j.cell.2023.09.025.
[2] doi: 10.1016/j.cell.2023.10.015.
[3] doi: 10.1101/cshperspect.a023812.
[4] doi: 10.1126/science.1190719.
[5] doi: 10.1016/j.cell.2021.03.008.
[6] doi: 10.1126/science.aaf4557.
[7] doi: 10.1126/science.1249252.
[8] SCIENCE VOLUME 355|ISSUE 6329|10 MAR 2017
[9] doi: 10.1186/s13059-020-02130-z.
[10] doi: 10.1126/science.1190719.
本文受科普中国·星空计划项目扶持
出品:中国科协科普部
监制:中国科学技术出版社有限公司、北京中科星河文化传媒有限公司
编辑:WX 审编:AD
中国公益新闻网版权及免责声明:
1、凡本网来源注明“中国公益新闻网”的所有新闻稿件和图片作品,版权均属于中国公益新闻网,未经本网授权,任何单位及个人不得转载、摘编或以其它方式使用上述作品。已经本网授权使用新闻稿件和图片作品的,应在授权范围内使用,并注明“来源:中国公益新闻网”。违反上述声明者,本网将追究其相关法律责任。
2、凡本网注明 “来源:XXX(非中国公益新闻网)”的新闻稿件和图片作品,系我方转载自其它媒体,转载目的在于传递更多信息,并不代表本网赞同其观点和对其真实性负责。
3、如因新闻稿件和图片作品的内容、版权和其它问题需要同本网联系的,请在15个工作日内告知我方。
4、联系方式:中国公益新闻网 电话:010-57256752 电子邮件:450952431@qq.com